Die VANDERWAALS KRÄFTE einfach erklärt Chemie TheScienceShow YouTube

1) where A is the Hamaker coefficient , which is a constant (~10 −19 − 10 −20 J) that depends on the material properties (it can be positive or negative in sign depending on the intervening medium), and z is the center-to-center distance; i.e., the sum of R 1 , R 2 , and r (the distance between the surfaces): z = R 1 + R 2 + r {\displaystyle \ z=R_{1}+R_{2}+r} . The van der Waals force.
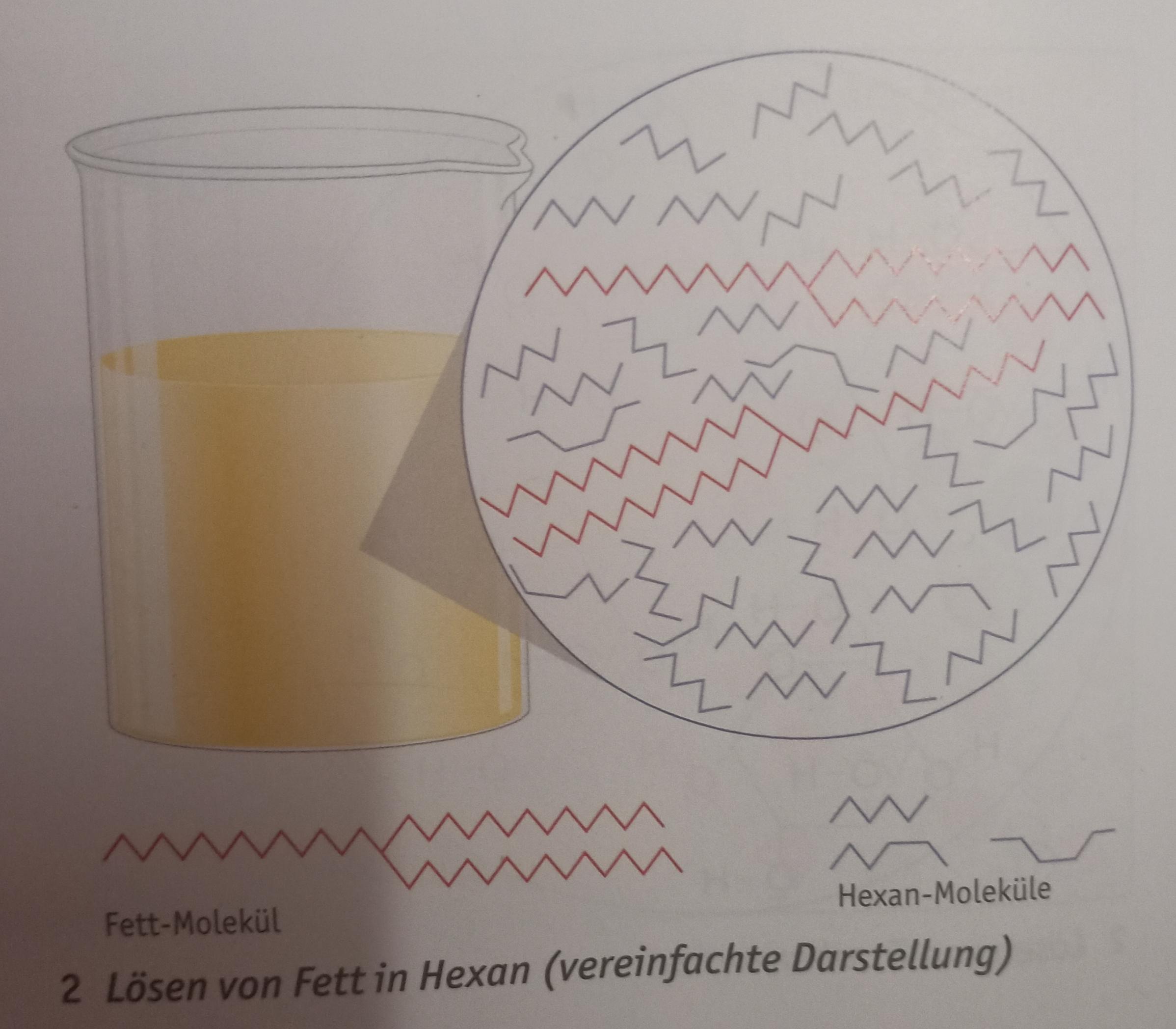
Löslichkeiten von Fett (Van der Waals Kräfte?)? (Chemie, alkane, Löslichkeit)
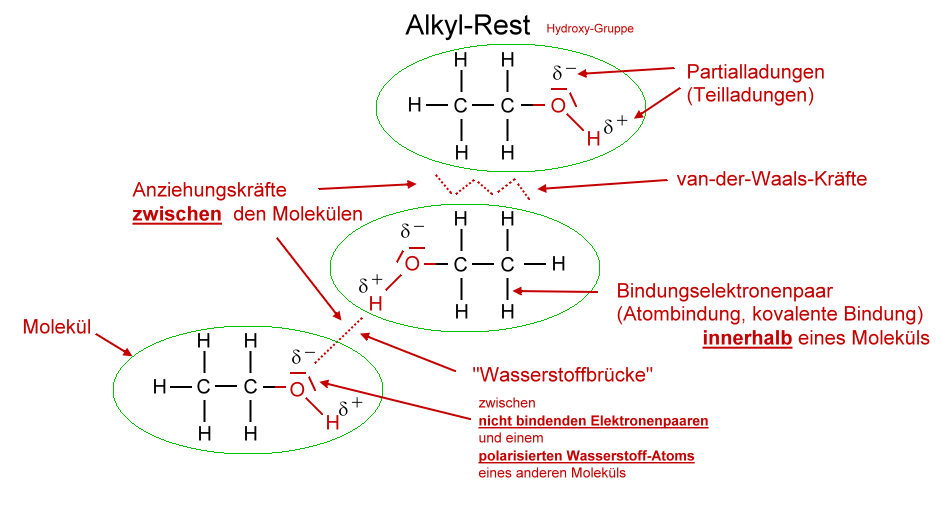
Exkurs: Zwischenmolekulare Kräfte Van-der-Waals-Kräfte: schwach Atome und Moleküle enthalten geladene Teilchen (Elektronen und Protonen). In einer gängigen Vorstellung bewegen sich die negativ geladenen Elektronen um die positiv geladenen Atomkerne. In einem solchen Modell kann es vorkommen, dass die Elektronen
Struktur/Eigenschaften Chemiezauber.de
Apply van der Waals forces to basic alkane characteristics, like boiling point. Distinguish between alkanes and cycloalkanes and organic molecules with functional groups. Alkane Bonding. Note that electrons seem to behave more like waves than like particles. So what is happening between two carbon atoms or a carbon atom and a hydrogen atom to.
vanderWaalsKräfte
Solubility in organic solvents. In most organic solvents, the primary forces of attraction between the solvent molecules are Van der Waals - either dispersion forces or dipole-dipole attractions. Therefore, when an alkane dissolves in an organic solvent, the Van der Waals forces are broken and are replaced by new Van der Waals forces.
PPT Alkane PowerPoint Presentation, free download ID5526286
Methan gehört zur homologen Reihe der Alkane und ist sein erster Vertreter. Es ist die einfachste Kohlenwasserstoffverbindung der Alkane.. sodass sich auch hier van der Waals-Kräfte zwischen den Molekülen ausbilden können. Brennbarkeit. Methan ist ein brennbares Gas. Brennbar bedeutet, dass es mit Sauerstoff zu Kohlenstoffdioxid und.
Van der WalsKräfte Chemische Bindungen YouTube

Die Van der Waals Kräfte sind zwischenmolekulare Kräfte die zwischen allen Molekülen auftreten können. Dabei werden sie nochmal in 3 Bestandteile aufgeteilt: Die Keesom Wechselwirkung zwischen zwei Dipolen sind die Dipol-Dipol-Kräfte, die Debye Wechselwirkung findest du zwischen einem Dipol und einem polarisierten Molekül. Hierbei handelt es sich also um Dipol-induzierter-Dipol-Kräfte.
Problemas De Fuerzas De Van Der Waals Docsity Mobile Legends

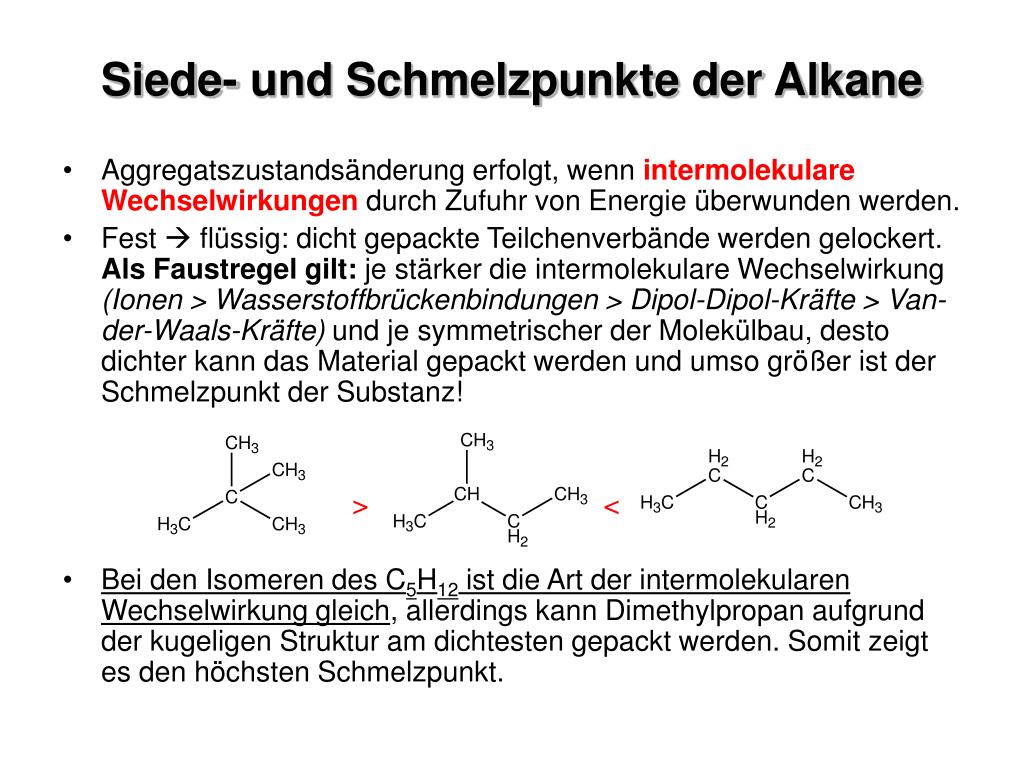
Der Grund dieses Trends liegt in den Van-der-Waals-Kräften, die quasi als eine Art Klebstoff der unpolaren Moleküle fungieren (Abschn. 1.5.1 ). Kohlenwasserstoffe, zu denen neben den Alkanen u. a. auch die Alkene und Alkine zählen, sind unpolare Verbindungen und werden durch die Van-der-Waals-Kräfte zusammengehalten.
Was sind VanderWaalsKräfte? YouTube

Ein kurzes Tutorial zur Einführung und Erklärung zu den van-der-Waals-Kräften in der Chemie und wie sie auf Atome wirken! Außerdem geht's um spontane und ind.
VanderWaalsKräfte mit den Isomeren von Hexan erkunden Unterrichtsmaterial im Fach Chemie

Van-der-Waals-Kräfte. Alle Moleküle, auch die unpolaren, üben Anziehungskräfte aufeinander aus. Diese bin-denden Kräfte nennt man Van-der-Waals-Kräfte (nach ihrem Entdecker, dem holländi-schen Physiker van der Waals, 1837-1923). Die Kräfte, mit denen sich die Moleküle gegenseitig anziehen, sind im Allgemeinen schwach.
VanderWaalsKräfte

Van-der-Waals-Kräfte Alle Moleküle, auch die unpolaren, üben Anziehungskräfte aufeinander aus. Diese bin-denden Kräfte nennt man Van-der-Waals-Kräfte (nach ihrem Entdecker, dem holländi-schen Physiker van der Waals, 1837-1923). Die Kräfte, mit denen sich die Moleküle gegenseitig anziehen, sind im Allgemeinen schwach.
Alkane Physikalische Eigenschaften
Van-der-Waals-Kräfte (Van-der-Waals-Wechselwirkungen), benannt nach dem niederländischen Physiker Johannes Diderik van der Waals, sind die relativ schwachen nicht-kovalenten Wechselwirkungen zwischen Atomen oder Molekülen, deren Wechselwirkungsenergie für kugelförmige Teilchen mit etwa der sechsten Potenz des Abstandes abfällt. Damit lassen sich die Van-der-Waals-Kräfte nach heutigem.
VanderWaalsKräfte · Entstehung & Beispiel · [mit Video]

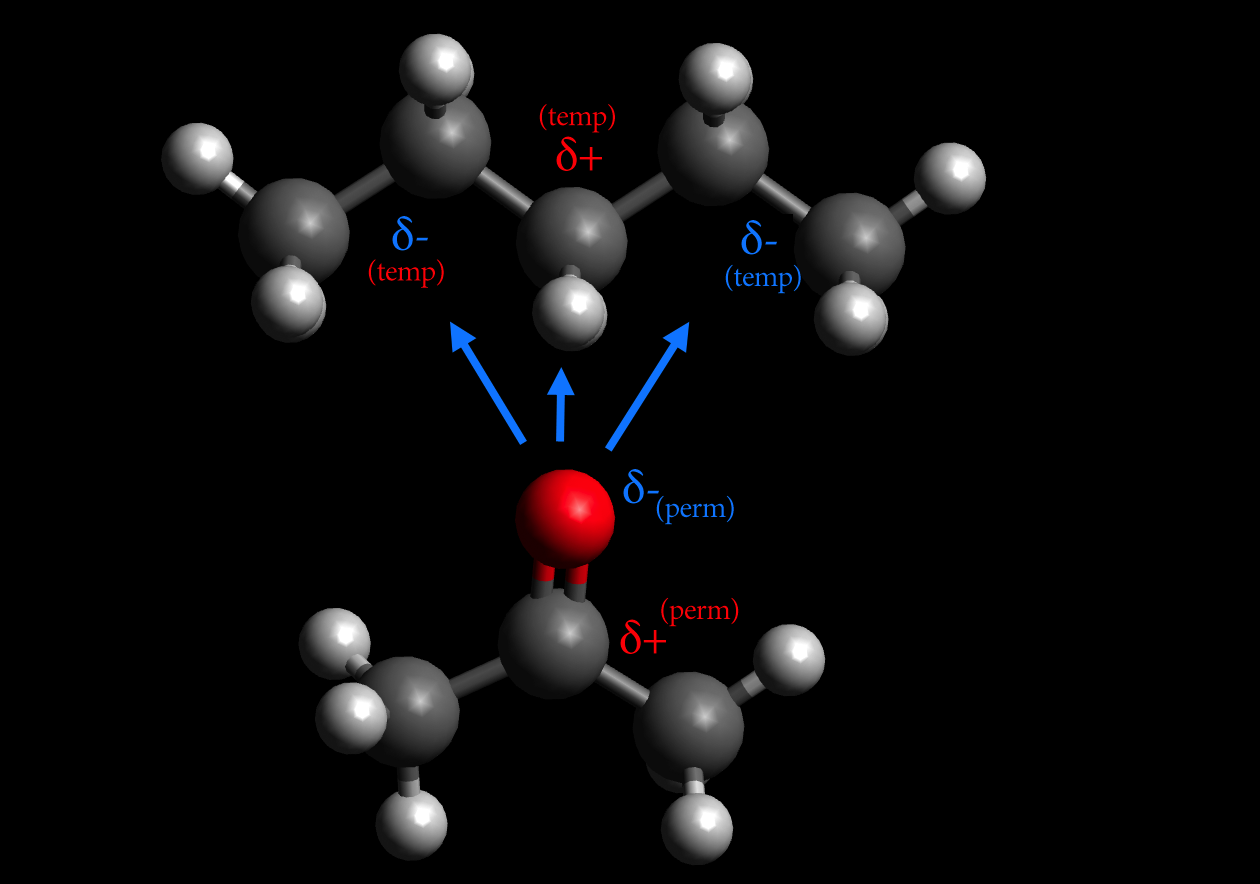
Die London-Dispersions-Wechselwirkungen sind also elektrostatische Anziehungskräfte zwischen schwachen, temporären und induzierten Dipolen und damit besonders schwache anziehende Van-der-Waals-Wechselwirkungen. Diese existieren in stärkerer Form zwischen großen, leicht polarisierbaren Molekülen, prinzipiell aber zwischen allen Teilchen.
VanderWaalsKraft neu vermessen
Die "Van-der-Waals-Wechselwirkungen im engeren Sinne" beschreiben die Verschiebung der Elektronen in unpolaren Molekülen. Diese sehr schwachen Wechselwirkungen können nur auf kurzer Distanz zwischen unmittelbar benachbarten Molekülen auftreten. Deshalb werden sie bei hohen Temperaturen durch die thermische Bewegung der Moleküle bereits.
Van der Waals Kräfte YouTube

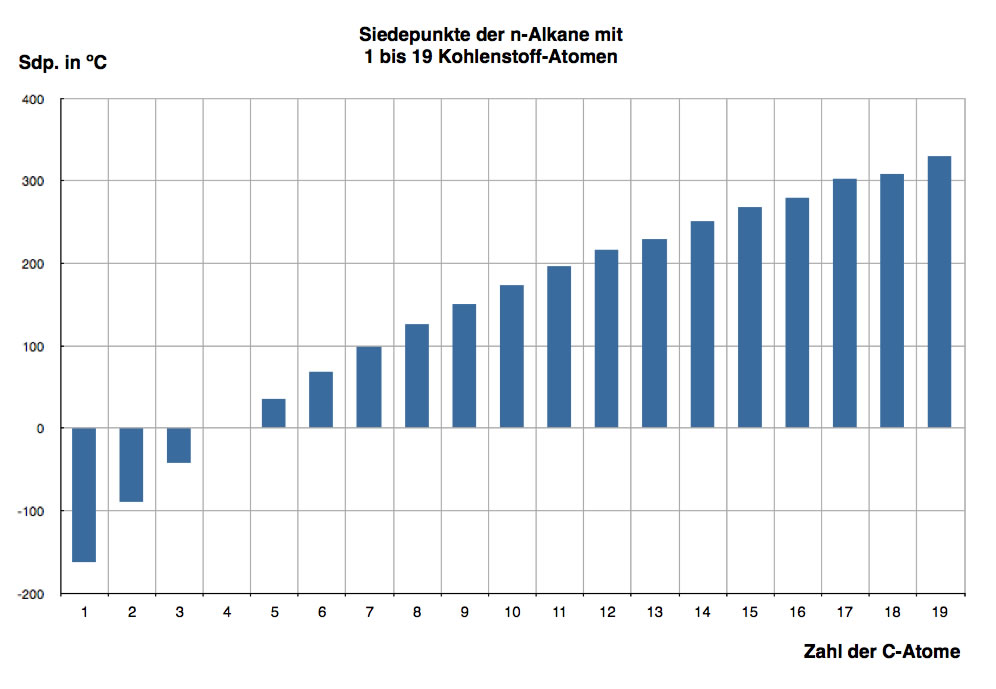
Auswirkungen der Van-der-Waals-Kräfte. Die Van-der-Waals-Kräfte sind für viele Eigenschaften von Molekülen verantwortlich.Solche Moleküle sind vor allem Kohlenwasserstoffe, wie zum Beispiel Alkane.. Je länger ein Molekül ist, desto mehr temporäre Dipole kann dieses ausbilden. Dadurch treten auch mehr, also stärkere, VdW-Kräfte zwischen den Molekülen auf.
Van Der Waals Forces Equation
Nach dem Physiker Johannes Diderik van der Waals (1837-1923) benannte Anziehungskräfte (Bindungskräfte) zwischen inerten Atomen bzw. gesättigten Molekülen mit einem temporär auftretenden (oszillierenden) Dipol. Durch die Elektronenbewegungen in der Atomhülle kommt es zu zeitlich variierenden, unsymmetrischen Ladungsverteilungen im Atom.
Van der Waals Kräfte einfach erklärt YouTube

Van-der-Waals-Kräfte in Alkanen . Der Einfluss der Van-der-Waals-Kräfte lässt sich am Beispiel der Alkane verdeutlichen: Mit zunehmender Kettenlänge nimmt der Siedepunkt zu. So hat Ethan zum Beispiel einen Siedepunkt von -88,6 °C, während n-Heptan einen Siedepunkt von 98,4 °C hat. Dieses Verhalten lässt sich durch die Van-der-Waals.